10 Den moderna fysikens utveckling: 10.3 Bohrs atommodell
 Bohrs postulat
Bohrs postulat
10.3 Bohrs atommodell
Bohrs postulat
År 1911 reste den 26 år gamla fysikern Niels Bohr från Köpenhamn till Rutherfords laboratorium i Manchester. Det var naturligt för honom att fortsätta försöka förstå atomernas natur.
Bohr gjorde som fysiker ofta gör när de står inför ett komplicerat problem. Han koncentrerade sig på det enklast möjliga fallet, väteatomen. Den består av en atomkärna omgiven av endast en elektron. Kärnan har en positiv elementarladdning och elektronen har en negativ.
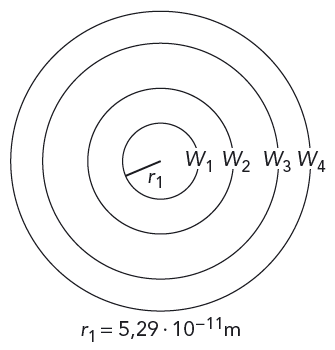
Bohr föreställde sig att elektronen kunde gå som en satellit i olika banor runt atomkärnan. Men i stället för tyngdkraften är det då den elektriska attraktionen mellan elektronen och kärnan som håller elektronen i sin bana. Han föreställde sig att elektronerna kunde lyftas ut till högre energinivåer precis som satelliter kan "lyftas" ut till banor med större mekanisk energi.

Bohr fortsatte arbetet med Rutherfords atommodell. Bohrs teori för atomen var ny och revolutionerande, och stod delvis i strid med den klassiska fysikens lagar.
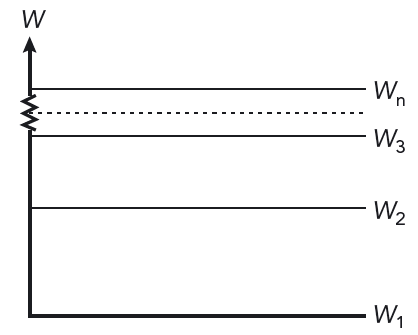
- En atom kan existera i många olika tillstånd utan att sända ut energi. I varje tillstånd har atomen en bestämd energi: \(W_1, W_2, W_3 \ldots\)
- En atom kan gå från ett tillstånd med energin \(W_\text{n}\) till ett annat tillstånd med lägre energi \(W_\text{m}\). Vid övergången sänds energiskillnaden ut som en foton.
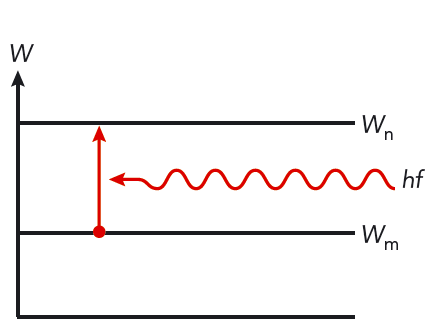
När en atom sänder ut ljus, tar atomen ett språng från en högre energinivå till en lägre energinivå. När atomen absorberar ljus, hoppar den från en lägre till en högre energinivå. Se figur 10.13. Normalt är många energisprång möjliga i en atom.
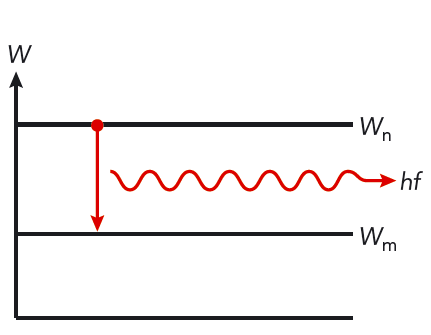
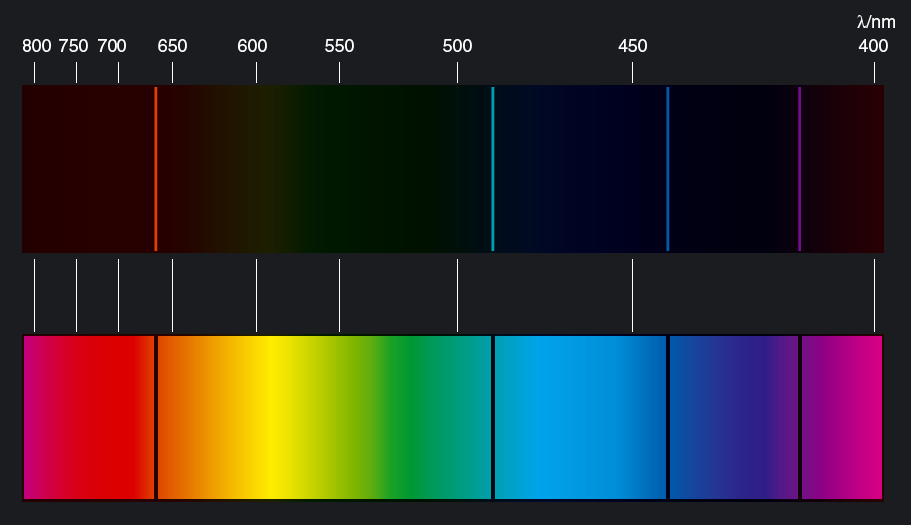
Varje språng ger upphov till ljus med en bestämd frekvens. Ljuset från ett sådant språng kallas spektrallinje.
Om vi ska få atomer att sända ut ljus, måste vi först excitera dem till energier över grundtillståndet. Det finns flera olika sätt att göra detta.
- Vi kan göra det genom att värma upp atomerna, till exempel ien gaslåga. Då tänker vi oss att atomerna blir exciterade när de kolliderar med varandra. Prova själv med lite koksalt (NaCl) ytterst på en nål och stick in nålen i lågan från ett ljus. Det skarptgula ljuset kommer från natrium.
- Eller så kan vi sända en ström genom en gas, som vi gör i lysrör. Då är det kollisioner med elektronerna i strömmen som exciterar gasatomerna.
- En tredje möjlighet är att sända ljus genom gasen. En atom kan då absorbera en foton från strålningen och använda energin för att komma upp i en högre energinivå. Atomerna absorberar bara fotoner som har samma energi som energidifferensen mellan två energinivåer. Alla andra fotoner passerar genom gasen.

