10 Den moderna fysikens utveckling: 10.1 Atomens historia
 Planetmodell
Planetmodell
Planetmodell

År 1896 kom nyzeeländaren Ernest Rutherford till Thomsons laboratorium i Cambridge. Hans första stora upptäckt var att det finns minst två typer av joniserande strålning, alfa- och betastrålning. Han visade att alfastrålningen är positiva heliumjoner, och att betastrålningen är elektroner. Joniserande strålning var tydligen något som hängde samman med atomen men den förde med sig mycket större energier än kemiska reaktioner. Hur skulle man kunna få veta mer om dessa atomer som är alltför små för att kunna ses i ett vanligt mikroskop?
Ett sätt skulle kunna vara att skicka de nyupptäckta alfapartiklarna mot atomer och se vad som hände. Rutherford valde att skicka alfapartiklar mot en tunn guldfolie, bara några få atomdiametrar tjock. Alfapartiklarna skulle då möta bara några få atomer på sin väg genom folien. En detektor bakom folien kunde registrera alfapartiklarna när de passerat genom folien.
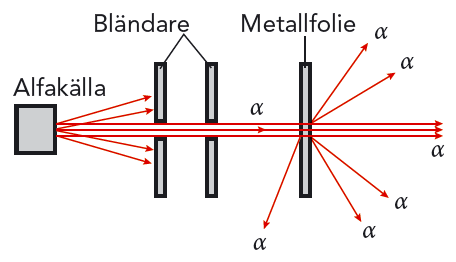
Rutherford upptäckte att de flesta alfapartiklarna gick rakt genom folien. Han kom fram till att dessa partiklar inte hade gått mellan guldatomerna, utan tvärs igenom dem. Se figur 10.6. Bara några få alfapartiklar böjdes av åt sidan. Men Rutherford blev mycket överraskad när han upptäckte att ett litet antal partiklar studsade tillbaka i samma riktning som de kommit! Utifrån bullmodellen var det som att skjuta med pistol genom en vetebulle och upptäcka att vissa kulor studsade tillbaka!
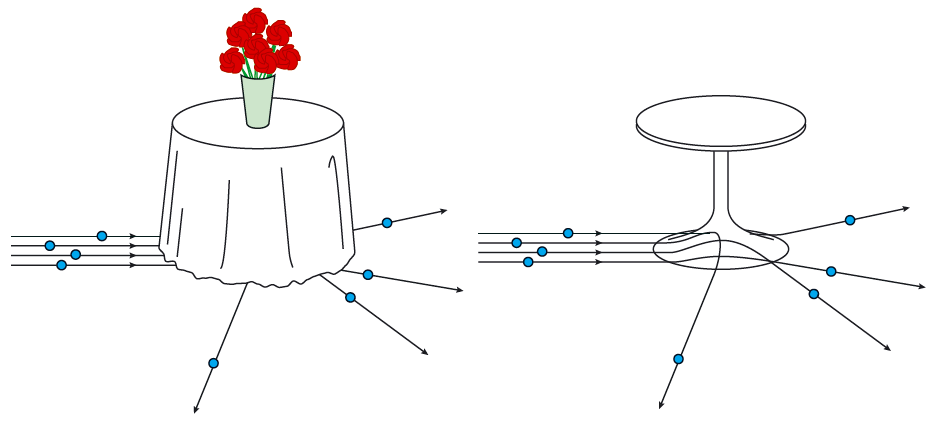
Tänk dig ett runt bord täckt av en duk som når ända ner till golvet. Du ska nu försöka lista ut vad som finns under bordet genom att rulla kulor mot bordet. När du ser hur kulorna kommer ut, och hur hög hastighet de har, kan du gissa hur det ser ut under bordet! Med den fot som visas i figuren får du samma resultat som Rutherford.
En sak var helt klar, bullmodellen måste vara felaktig. År 1911 ersattes den därför av Rutherfords planetmodell. Se figur 10.8.
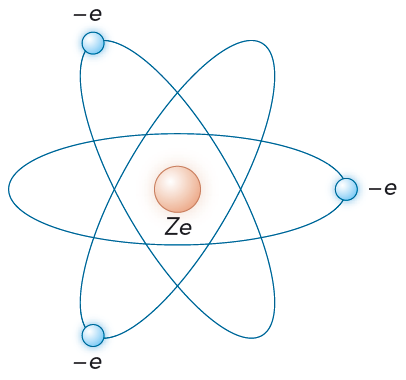
Atomen i grundämnet \(Z\) består av \(Z\) lätta elektroner som kretsar i ett sfäriskt tomrum runt en relativt liten och tung kärna. Kärnan har en positiv laddning \(Ze\), där \(e\) är elementarladdningen. Praktiskt taget hela atommassan är samlad i atomkärnan.
Observera hur tom en atom är! Om du förstorar atomen så att kärnan blir stor som ett knappnålshuvud med diametern ca \(1\) millimeter, så blir elektronerna små prickar som kretsar \(100 \text{ m}\) från kärnan! Ändå känns ett bord hårt när du knackar på det.
Nu kan vi förklara Rutherfords försöksresultat: De flesta alfapartiklarna går genom tomrummet i atomen. Någon enstaka gång kommer en alfapartikel så nära en kärna att den avböjs kraftigt av de elektriska krafterna från kärnan.

