11 Kärnfysik: 11.1 Atomkärnan
 Protoner och neutroner
Protoner och neutroner
11.1 Atomkärnan
År 1911 upptäckte Rutherford atomkärnan. Från och med då blev fysikerna mer och mer klara över att den är en värld för sig, rik på fenomen som krävde förklaring. År 1919 visade Rutherford att vätekärnan är en partikel. Den kallades proton och visade sig ha en positiv laddning som var lika stor som elektronladdningen, \(e = 1{,}60 \cdot 10^{-19} \text{ C}\). Massan \(m_\text{p} = 1,67 \cdot 10^{-27} \text{ kg}\) var däremot betydligt större än elektronmassan.
Noggranna mätningar visade att atomer av samma grundämne kunde ha olika massor. De kallades isotoper. Men vad var skillnaden mellan isotoperna? Vad var egentligen en atomkärna?
Marie och Pierre Curie fick två döttrar. Den äldsta dottern Irène fortsatte tillsammans med sin make Frédéric Joliot att forska kring radioaktiviteten. I början av 1930-talet gjorde makarna Joliot-Curie experiment som gav en hård neutral strålning. De trodde att det var extremt energirik gammastrålning. Men den engelske fysikern James Chadwick upptäckte att det var neutrala partiklar med ungefär samma massa som protonens. Neutronen var upptäckt.
Protoner och neutroner
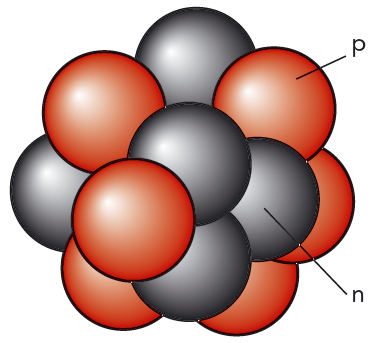
Efter det att neutronen upptäckts, blev det klart att atomkärnan är uppbyggd av protoner och neutroner. Se figur 11.1.
Antalet protoner i kärnan kallar vi protontalet \(Z\). Det är lika med atomnumret för motsvarande grundämne. Antalet neutroner kallar vi neutrontalet \(N\). Protoner och neutroner har fått det gemensamma namnet nukleoner.
Antalet nukleoner i kärnan kallar vi nukleontalet \(A\). \[ A = Z + N \] där \(Z\) är protontalet och \(N\) neutrontalet. \(A\) kallas även masstal.
Alla atomer i ett grundämne har samma protontal \(Z\), medan neutron talet \(N\) kan variera. Olika isotoper av samma grundämne har alltså samma protontal, men olika neutrontal.
En atomkärna \(\rm X\) med \(Z\) protoner och \(A\) nukleoner skriver vi som \[ \ce{ ^{$A$}_{$Z$} $\rm X $ } \] där \(\rm X\) är symbolen för grundämnet. En neutral atom har dessutom \(Z\) elektroner runt kärnan.
En neutral atom med alla sina elektroner kallar vi för en nuklid.
Den vanligaste kolkärnan är \( \ce { ^{12}_6 $ \rm C$} \) . Den har \(Z = 6\) protoner och \(A = 12\) nukleoner. Neutrontalet är \(N = A - Z = 12 - 6 = 6\). Nukliden \( \ce { ^{12} $ \rm C $} \) är en kolatom med \(12\) nukleoner i kärnan och \(6\) elektroner utanför kärnan.
Den radioaktiva kolkärnan \( \ce { ^{14}_{6} $ \rm C$} \) har däremot \(6\) protoner och \(14 - 6 = 8\) neutroner. Nukliden \( \ce { ^{14} $\rm C$} \) nukleoner i kärnan och \(6\) elektroner utanför kärnan.
Lägg märke till att symbolen \( \ce { ^{$A$}_{$Z$} $ \rm X$} \) för en kärna har både masstalet \(A\) och protontalet \(Z\), medan symbolen \( \ce { ^{$A$} $ \rm X$} \) för en nuklid bara har masstalet \(A\). Det är för att markera att nukliden är en neutral atom.
I kärnreaktioner kommer vi då och då att använda bestämda symboler för nukleoner och elektroner. Vi använder symbolen \( \ce { ^{1}_{1} $ \rm p $} \) för protonen, \( \ce { ^{1}_{0} $ \rm n$} \) för neutronen och \( \ce { ^{0}_{-1} $ e $} \) för elektronen.

