7 Termofysik: 7.3 Tillståndslagen för ideala gaser
 7.3 Tillståndslagen för ideala gaser
7.3 Tillståndslagen för ideala gaser
7.3 Tillståndslagen för ideala gaser
Även om vi vet vad som händer på mikronivå, kan vi aldrig observera det direkt. Det vi kan observera är de så kallade makroskopiska storheterna temperatur \(T\), tryck \(p\) och volym \(V\). Eftersom dessa storheter styrs av det som händer på mikronivå finns det ett samband mellan dem även på makronivå. Om vi känner två av dem så kan vi räkna ut den tredje. Eftersom tillståndet för en bestämd mängd gas bestäms av temperaturen, trycket och volymen kommer vi i fortsättningen att kalla dem för gasens tillståndsstorheter. När gasmängden är given, är gasens tillstånd entydigt bestämt av \(p\), \(V\) och \(T\).
Sambandet mellan tillståndsstorheterna ges av tillståndslagen för gaser:
Mellan trycket \(p\), volymen \(V\) och absoluta temperaturen \(T\) i en isolerad ideal gas gäller sambandet \[ \frac{pV}{T} = \text{konstant} \]
Konstanten beror på vilken gas vi betraktar och hur stor gasmängd vi hanterar. Den blir större för en stor gasmängd än för en liten.
Den ideala gasmodellen utgår från en modell där gasmolekylerna inte tar någon plats och inte påverkar varandra med krafter. I verkligheten däremot är den tillgängliga volymen reducerad med gasmolekylernas samlade volym. Det är ungefär den plats molekylerna skulle ta i sin flytande fas. Trycket reduceras även något av att gasmolekylerna attraherar varandra svagt med molekylkrafter.
I praktiken stämmer tillståndslagen mycket bra för verkliga gaser vid normala värden på tryck och temperatur. Det beror på att medelavståndet mellan molekylerna är så stort att molekylkrafterna för det mesta är mycket små. Den flytande fasens volym är också liten jämfört med gasens volym vid normalt lufttryck och vid temperaturer en bit över smältpunkten. Vatten till exempel tar ungefär 800 gånger större plats som gas än som vätska.
Om den ideala gasen övergår från ett begynnelsetillstånd \( (p_1, V_1, T_1) \) till ett sluttillstånd \( (p_2, V_2, T_2)\), kan vi skriva tillståndslagen som \[ \frac{p_1V_1}{T_1} = \frac{p_2V_2}{T_2} \]
Vi säger att en gas är i normaltillståndet när den har trycket \( p_0 = 101{,}3 \text{ kPa} \) och temperaturen \(T_0 = 273 \text{ K}\). Volymen i normaltillståndet kallar vi \(V_0\). Tillståndslagen för en given gasmängd kan vi då skriva som \[ \frac{pV}{T} = \frac{p_0V_0}{T_0} \] där \( (p, V, T) \) är ett fritt valt tillstånd för gasen.
Fysiktabellen ger densiteten för gasen i normaltillståndet. Om vi kan beräkna den volym en gas skulle ha haft i normaltillståndet, så kan vi också beräkna gasens massa. Massan för en bestämd gasmängd är ju lika stor i alla tillstånd.
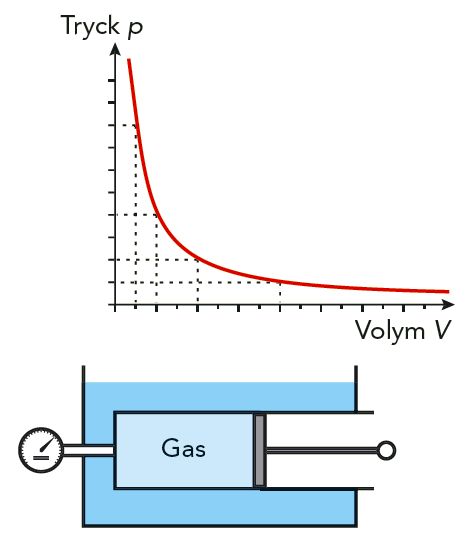
Tillståndslagen är egentligen en kombination av tre gaslagar, som upptäcktes vid en rad olika försök. En av dem är Boyles lag.
Om en gas har konstant temperatur, kan vi skriva tillståndslagen som \(pV = \text{konstant}\), eller \[ p_1V_1 = p_2V_2 \ (T \text{ konstant}) \] Den irländske fysikern Robert Boyle (1627 - 1691) upptäckte denna lag år 1660. Se figur 7.19.
Boyles lag är rimlig utifrån den mikroskopiska gasmodellen. När vi halverar volymen, blir det dubbelt så många molekyler på kollisionsavstånd från väggarna. Eftersom temperaturen är konstant, har molekylerna samma genomsnittliga kinetiska energi som tidigare. Det betyder dubbelt så många kollisioner, lika våldsamma som tidigare. Alltså en fördubbling av trycket.
Du fyller på luft i bildäcken en vinterdag när temperaturen är \(t_1 = -32 \text{ °C}\). Tryckmätaren på bensinstationen visar att trycket i däcken är \(2{,}85 \cdot 10^5 \text{ Pa}\) över atmosfärstrycket, som är \(103 \text{ kPa}\) den dagen.
Sedan parkerar du i ett uppvärmt garage där temperaturen är \(t_2 = 18 \text{ °C}\) . Hur stort blir lufttrycket i däcken där?
Lösning: De två temperaturerna är \[ T_1 = t_1 + T_0 = (-32 + 273) \text{ K} = 241 \text{ K} \] \[ T_2 = t_2 + T_0 = (18 + 273) \text{ K} = 291 \text{ K} \]
Vi antar att luftvolymen är lika stor i bägge fallen, \(V_2 = V_1\).
Av tillståndslagen \(\displaystyle \frac{p_2V_2}{T_2} = \frac{p_1V_1}{T_1} \ \) får vi då att trycket \(p_2\) blir \[ p_2 = \frac{p_1T_2}{T_1} = \frac{(2{,}85 + 1{,}03) \cdot 10^5 \cdot 291}{241} \text{ Pa} = 4{,}68 \cdot 10^5 \text{ Pa} \] Det betyder att övertrycket i däcken nu är \[ \Delta p = (4{,}68 - 1{,}03) \cdot 10^5 \text{ Pa} = 3{,}65 \cdot 10^5 \text{ Pa}\]
Du bör alltså ta hänsyn till temperaturen när du fyller på luft i däcken!
Ibland händer det att en dykare mister lufttillförseln nere på djupet. Då måste hon göra en snabb uppstigning. Den naturliga reaktionen när det är långt till ytan och man har andnöd skulle vara att hålla andan. Men dykare får tvärtom lära sig att på vägen upp till ytan läcka luft t.ex. genom att säga "mmmmm". Varför, tror du?

Nere i djupet andas dykaren in komprimerad luft. Samma mängd luft som fyller lungorna i djupet, spränger dem närmare ytan. Därför måste dykaren släppa ut luft på vägen upp. Men det är inte säkert att faran är över vid ytan. När trycket minskar för fort kan dykaren drabbas av dykarsjuka. Då börjar koldioxiden som är löst i blodet att bubbla, som när du tar korken av en läskflaska. Det är ett livsfarligt tillstånd som i bästa fall kan hävas i en tryckkammare.

