5 Kemiska beräkningar: Olika partiklars massor
 Formelmassa och formelenhet
Formelmassa och formelenhet
Det lättaste grundämnet är väte, H, som har atommassan #1,01 # u. En syreatom väger #16,00 # u. Utifrån det värdet kan vi beräkna massan för en vattenmolekyl, H2O, genom att addera de ingående atomernas massor:
#1,01 # u #\cdot\, 2 + 16,00 # u #= 18,02 # u. Det är vattnets formelmassa.
Viktigt
Formelmassan är summan av massorna för de atomer som ingår i ämnets formel.
Ett ämnes formelmassa beräknar man alltså genom att addera atommassorna för alla de atomer som ingår i ämnets formel.
Vattnets formelmassa kan även kallas molekylmassa, eftersom vatten består av molekyler. Begreppet molekylmassa kan endast användas för molekylföreningar, medan formelmassa kan användas för alla typer av ämnen.
Viktigt
Molekylmassan är summan av massorna för de atomer som ingår i en molekyl av ämnet.
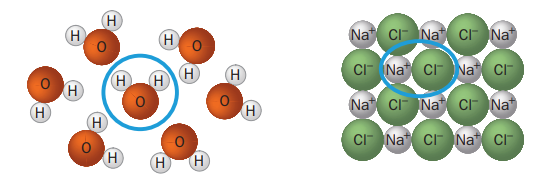
Den blå ringen markerar en formelenhet av respektive ämne.
Viktigt
Kristallvatten #- # vattenmolekyler som är bundna till jonerna i ett fast salt.
Små joner kan bilda stora kristaller. En geolog står bland stora gipskristaller i en grotta i Chihuahua i Mexiko. Det har tagit miljontals år för kristallerna att växa sig så stora.
I vissa jonföreningar binds vattenmolekyler till jonerna i kristallen. Dessa molekyler kallas för kristallvatten. Antalet vattenmolekyler varierar för olika jonföreningar. Formeln för gips skrivs CaSO4# \cdot 2 #H2O. Punkten i formeln är inte ett multiplikationstecken! Den visar istället att varje formelenhet av ämnet förutom CaSO4 även innehåller två vattenmolekyler. När formelmassan beräknas adderar man molekylmassan för #2 # vattenmolekyler till formelmassan för kalciumsulfat: #136 # u #+ 2 \cdot 18,0 # u #= 172 # u.
Om man värmer gips förångas nästan allt vatten och lämnar saltet. Det som blir kvar kallas bränd gips, som har formeln CaSO4# \cdot 0,5 #H2O. Formelmassan för bränd gips är #136 # u #+ 0,5 \cdot 18,0 # u #= 145 # u.
Tre elementarpartiklar i materia
| BERÄKNING AV NÅGRA ÄMNENS FORMELMASSOR | ||
| #\;#ozon O3 | #16,0 \text{ u}\cdot 3 = 48,0# u | |
| #\;#natriumklorid NaCl | #23,0 \text{ u} + 35,5 \text{ u} = 58,5 \text{ u}# | |
| #\;#kvävedioxid NO2 | #14,0 \text{ u} + 16,0 \text{ u} \cdot 2 = 46,0# u | |
| #\;#dikopparoxid Cu2O | #63,5\text{ u}\cdot 2 + 16,0\text{ u}=143 \text{ u}# | |
| #\;#vatten H2O | #1,01\text{ u}\cdot 2 + 16,0\text{ u} = 18,0 \text{ u}# | |
| #\;#metan CH4 | #(12,0 + 1,01\cdot 4) \text{ u} = 16,0 \text{ u}# | |
| #\;#etanol C2H5OH | #(12,0\cdot 2 + 1,01\cdot 5 + 16,0 + 1,01) \text{ u} = 46,1# | |
| #\;#kristalliserad kalciumklorid CaCl2# \cdot 6 #H2O | #40,1\text{ u}+35,5\text{ u}\cdot 2 + 18,0\text{ u} \cdot 6 = 219 \text{ u}# | |
| #\;#kristalliserat kopparsulfat CuSO4# \cdot 5 #H2O | #63,5 \text{ u} + 32,1 \text{ u} + 16,0 \text{ u} \cdot 4 +18,0 \text{ u} \cdot 5 = 250 \text{ u}# | |
| #\;#kristalliserat natriumkarbonat Na2CO3# \cdot 10 #H2O | #23,0 \text{ u} \cdot 2 + 12,0 \text{ u} + 16,0 \text{ u}\cdot 3 + 18,0 \text{ u} \cdot 10 = 286 \text{ u}\;# | |
Elektronens massa är mycket liten jämfört med massan av en proton respektive neutron #- # den är mindre än en tusendel av protonens massa. När man beräknar formelmassan för jonföreningar, försummar man därför alltid massan av de elektroner som avgavs eller togs upp när jonerna bildades. Elementarpartiklarnas massor hittar du i tabellen på s. #57.#