5 Kemiska beräkningar: Sammansättning av föreningar och lösningar
 Masshalt och volymhalt av ämnen i lösningar
Masshalt och volymhalt av ämnen i lösningar
I Östersjön är salthalten betydligt lägre. Det beror på att många älvar rinner ut i Östersjön och att avdunstningen inte är så stor. Om #100 # g vatten från mellersta Östersjön får avdunsta blir det cirka #0,7 # g salt kvar. Salternas masshalt är då cirka #0,7 \, \%# .
Viktigt
#{\text{Masshalten}} = \frac{{{\text{det lösta ämnets massa}}}}{{{\text{hela lösningens massa}}}}#
För lösningar som vi använder hemma anges ofta masshalten på förpackningen. Halten ättiksyra i vinäger är cirka #6 \, \%# , vilket betyder att det finns #6 # g ättiksyra i #100 # g vinäger.
Viktigt
Lösningsmedel är ämnet med högst koncentration i en lösning.
Vatten är ett bra lösningsmedel för natriumklorid #- # i #1 # dl kallt vatten går det att lösa cirka #36 # g natriumklorid. Om man häller i ännu mer salt, lägger sig olösta kristaller på botten. Man säger att lösningen är mättad.
Viktigt
En mättad lösning innehåller maximal mängd av det upplösta ämnet.
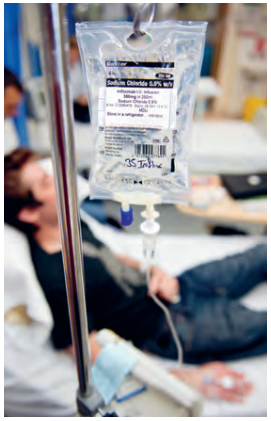
Fysiologisk koksaltlösning har masshalten #0,9 \, \%#. Det är samma halt av natriumklorid som i kroppen. Vid operationer och andra blödningar kan man få fysiologisk koksaltlösning direkt in i blodet via dropp.
I fysiologisk koksaltlösning, det vill säga en lösning med samma salthalt som vi har i kroppen, är masshalten natriumklorid #0,9 \, \%# . Det innebär att det finns #0,9 # g natriumklorid i #100 # g av lösningen. För att göra #1 # liter fysiologisk lösning ska #9 # g natriumklorid (rent koksalt) alltså vägas upp och lösas i så mycket vatten att lösningens totala massa (vatten #+ # koksalt) blir #1000 # g. Om lösningen görs på kokt vatten kan den användas till sårtvätt eller som näsdroppar.
Viktigt
#1# l #=1\text{ dm}^3#
#1# ml #=1\text{ cm}^3#
#1000# ml #=1000\text{ cm}^3=1 \text{ dm}^3#
På flaskor med alkoholhaltiga drycker står volymhalten angiven. På en ölburk kan det stå " #2,8 \, \%# vol". Om det är en halvliters ölburk har den alltså volymen #0,5 # dm #^{3}. 2,8 \, \%# betyder då #0,028 \cdot 0,5 \text{ dm}^{3} = 0,014 \text{ dm}^{3} # ren alkohol (etanol). Med hjälp av densiteten, som är #0,79\text{ g/cm}^{3} # för etanol, kan vi beräkna hur stor massa etanol som ölen innehåller. En halvliters ölburk med #2,8 \, \%# volymhalt innehåller #14 \text{ cm}^{3} \cdot 0,79 \text{ g/cm}^{3} = 11 # g etanol.
På en etikett på en vinflaska står det " #13 \, \%# by volume". Om flaskan rymmer #0,75 \text{ dm}^{3} # och vinet har #13 \, \%# volymhalt innehåller vinet i flaskan #0,13 \cdot 0,75 \text{ dm}^{3} = 0,098 \text{ dm}^{3} # ren alkohol.
Även gasblandningars sammansättningar anges i volymhalt. Luftens syrehalt är #21 # volymprocent och kvävehalten är #78 # volymprocent. Begreppet volymprocent används ibland för att tydliggöra att det gäller just volymhalt.