5 Kemiska beräkningar: Koncentration i lösningar
 Koncentration i lösningar
Koncentration i lösningar
Oftast väger vi inte vattenlösningar av ämnen. Istället mäter vi upp en viss volym av lösningen. För lösningar är det därför viktigt att veta vilken substansmängd av ett ämne som finns i en viss volym.
Begreppet koncentration är en storhet som anger hur stor substansmängd av ett ämne som finns per volymenhet av en lösning. Koncentration anges förkortat med #c# och har enheten #1 \text{ mol/dm}^{3}, # eller #1 \text{ mol}\cdot \text{ dm}^{-3}.#
# n # är substansmängden (i mol) av det upplösta ämnet, och # V # är lösningens volym (i #\text{dm}^{3}#).
Sambanden mellan substansmängd, koncentration och volym av en lösning beskrivs av följande formler:
| SUBSTANSMÄNGD | #\mathbf{=}# | KONCENTRATION | #\mathbf{\cdot}# | VOLYM | |
| BETECKNING | #\hspace{4mm} n# | #c# eller #[\,]##\text{}^*# | #V# | ||
| ENHET | #\hspace{4mm} 1# mol | #1 \text{ mol/dm}^3# | #1 \text{ dm}^3# | ||
| SAMBAND | #\hspace{4mm} n=c\cdot V# | #c=n/V# | #V=n/c# |
*
Koncentration är ett praktiskt begrepp, som gör att man kan beräkna hur stor volym som ska mätas upp för att få en viss substansmängd av ett upplöst ämne. En lösning kan innehålla flera olika lösta ämnen. De lösta ämnenas koncentrationer anges då var för sig. Exempel på sådana lösningar är så kallade buffertlösningar. De innehåller en viss koncentration av en syra och en viss koncentration av en bas för att lösningen ska få ett speciellt och stabilt pH-värde. Det här tar vi upp i nästa kapitel om syror och baser.
Exempel
#12.# I #0,50 \text{ dm}^3# kopparsulfatlösning finns #0,20# mol kopparsulfat. Beräkna lösningens koncentration.
Lösning
Koncentration #c=\frac{n}{V}=\frac{0,20\text{ mol}}{0,50 \text{ dm}^3} = 0,40\text{ mol/dm}^3#
Svar
Koncentrationen av kopparsulfat är #0,40\text{ mol/dm}^3#
Exempel
#13.# Vad är masshalten salpetersyra, HNO3, i koncentrerad salpetersyra med koncentrationen #16 \text{ mol/dm}^3# och densiteten, #\rho#, #1,42 \text{ g/cm}^3#?
Lösning
Vi räknar på #1,0\text{ dm}^3# syralösning.
Svar
Masshalten HNO3 i koncentrerad salpetersyra är #71\, \%#
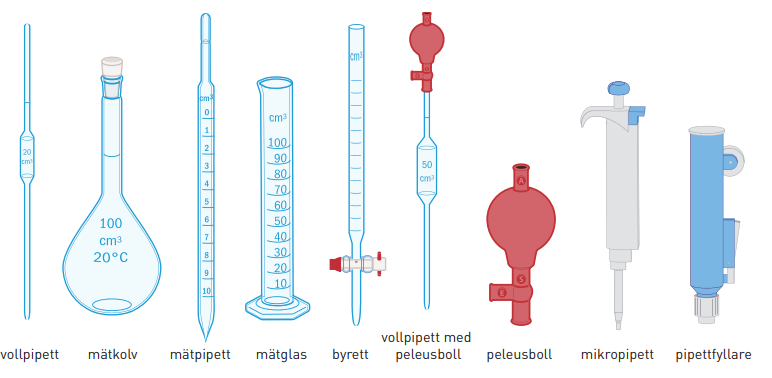
Olika redskap för volymmätning: vollpipett, mätkolv, mätpipett, mätglas, byrett, peleusboll, mikropipett och pipettfyllare. En peleusboll används för att suga upp vätskan i pipetten. Med mikropipetter kan man mycket noggrant mäta små volymer i storleksordningen µl. De har engångsspetsar av plast.