5 Kemiska beräkningar: Koncentration i lösningar
 Att göra en lösning med önskad koncentration
Att göra en lösning med önskad koncentration
Innan man bereder (blandar till) en vattenlösning av ett ämne måste man bestämma följande:
- Den koncentration som lösningen ska ha.
- Hur stor volym lösningen ska ha.
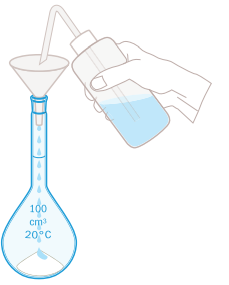
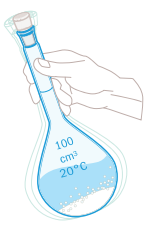
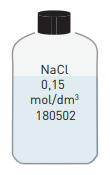
Här beskriver vi hur du, på ett noggrant sätt, bereder en koksaltlösning, NaCl(aq), med volymen #1,0 \text{ dm}^{3} # och koncentrationen #0,15 \text{ mol/dm}^{3}. # Substansmängden NaCl i lösningen är då #0,15 # mol. Det motsvarar #8,8 # g koksalt som du väger upp noggrant.
Så här bereder du en koksaltlösning
Exempel
#14. # Hur bereder man en sockerlösning (sackaros, C12H22O11) med volymen #0,500 \text{ dm}^3# och koncentrationen #0,400 \text{ mol/dm}^3# ? Skriv en instruktion.
Lösning
Beräkna först den substansmängd socker (C12H22O11) som behövs och därefter dess massa.
Svar
Väg upp #68,4# g socker och häll ner det i en mätkolv som rymmer #0,500 \text{ dm}^3# . Häll på lite avjonat vatten och skaka om blandningen så att alla kristaller löser sig. Fyll kolven till hälften med avjonat vatten och skaka den sedan försiktigt så att lösningen blandas om. Fyll sedan upp till märket på mätkolvens hals, som markerar exakt volymen #0,500 \text{ dm}^3# . Sätt i proppen i kolven och skaka ordentligt. Häll upp den färdiga lösningen i en flaska, som du märker ”#0,400 \text{ mol/dm}^3# C12H22O11 (aq)”.