5 Kemiska beräkningar: Koncentration i lösningar
 Att späda en lösning
Att späda en lösning
Ett annat sätt att bereda en lösning är att späda en lösning med hög koncentration till en ny lösning med lägre koncentration. Så gör man till exempel med juice som säljs i koncentrerad form i #2 # dl-förpackningar. Innehållet i en förpackning brukar man blanda med fyra gånger så mycket vatten till slutvolymen #1 # liter. Eftersom man ökar vattenmängden blir koncentrationerna av de lösta ämnena mycket lägre. Koncentrationerna är då #\frac{1}{5}# av vad koncentrationerna var i den outspädda juicen.
Även i labbet späder man lösningar med höga koncentrationer för att få nya lösningar med lägre koncentrationer. I exempel #15 # visar vi hur man beräknar den volym av en koncentrerad lösning, som ska överföras till en mätkolv och sedan spädas till större volym och lägre koncentration.
Exempel
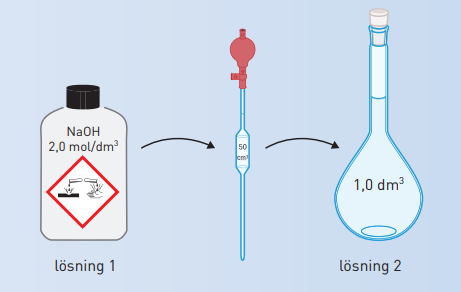
#15.# Hur stor volym NaOH-lösning med koncentrationen #2,0 \text{ mol/dm}^3# behöver man för att bereda #1,0 \text{ mol/dm}^3# utspädd lösning med koncentrationen #0,10 \text{ mol/dm}^3#?
Lösning
Den substansmängd NaOH som den spädda lösningen, lösning #2#, ska innehålla, tar man från lösningen med hög koncentration, lösning #1#.
Lösning 2:
Beräkna först den substansmängd socker (C12H22O11) som behövs och därefter dess massa.
Från lösning #1# behövs alltså substansmängden #0,10# mol.
Hur stor volym ska man då ta av lösning #1# för att få den substansmängden.
Lösning 1:
Beräkna först den substansmängd socker (C12H22O11) som behövs och därefter dess massa.
Svar
Man tar alltså #50 \text{ cm}^3# NaOH-lösning med koncentrationen #2,0 \text{ mol/dm}^3# och späder till volymen #1,0 \text{ dm}^3#
#50 \text{ cm}^3# NaOH med koncentrationen #2,0 \text{ mol/dm}^3# späds #1,0 \text{ dm}^3#. Den nya lösningens koncentration blir #0,10\text{ mol/dm}^3#