5 Kemiska beräkningar: Räkna på kemiska reaktioner
 Metoden för att skriva reaktionsformler
Metoden för att skriva reaktionsformler
Arbetsgången för att skriva en korrekt reaktionsformel är att i tur och ordning besvara följande fyra frågor:
|
|
För exemplet när det bildas ammoniak gäller att
#\color{purple}{1.}# Kväve och väte reagerar till ammoniak. Reaktanterna i exemplet är kväve och väte som står till vänster om pilen. Till höger står reaktionsprodukten, ammoniak. Detta skrivs
#\color{purple}{2.}# Reaktanternas formler är N2 för kväve och H2 för väte; båda ämnena består av tvåatomiga molekyler. Reaktionsprodukten är NH3#, #ammoniak.
#\color{purple}{3.}# Vid kemiska reaktioner försvinner eller nybildas inga atomer. Därför ska reaktionsformeln balanseras, så att det finns lika många atomer av varje grundämne till vänster och till höger om pilen. Tvärstrecket över pilen i reaktionsformeln ovan visar att formeln inte är balanserad.
Ämnenas formler får inte ändras eftersom de då inte korrekt beskriver deras sammansättning. Varje ämnes formel är ju likvärdig med en formelenhet. Tänk dig att du lägger varje formelenhet i varsin låda.
Innehållet i varje låda får inte ändras eftersom det beskriver ämnet. Det är istället antalet lådor av varje ämne som ändras. Det totala innehållet i alla lådorna till vänster om reaktionspilen ska kunna tömmas och bilda ett antal lådor med en formelenhet per låda av ämnet på den högra sidan om pilen.
Första frågan blir: Hur många lådor med NH3 kan det bildas av en låda med N2? Det kan bildas två lådor, eftersom det finns två kväveatomer i varje låda. Talet #2 # skrivs framför lådan med NH3#.#
Nästa fråga blir: Hur många lådor med H2 behövs det för att två lådor med NH3 ska kunna bildas? Det behövs totalt #6 # väteatomer. Varje låda innehåller #2 # väteatomer. Alltså behövs det #3 # lådor.
Den här reaktionsformeln balanseras alltså i två steg. En kontroll visar nu att det finns lika många atomer av varje slag till vänster som till höger om pilen (#2 # kväveatomer och #6 # väteatomer). Reaktionsformeln är balanserad och vi kan nu ta bort tvärstrecket över reaktionspilen.
Viktigt
En reaktionsformel balanseras med koefficienter.
Talen framför ämnenas formler kallas koefficienter och anger alltså förhållandet mellan de reagerande ämnenas och de bildade produkternas substansmängder.
#\color{purple}{4.}# Aggregationstillståndet för varje ämne visas med symbolerna (g) för gasform, (l) för flytande (liquidus), (s) för fast (solidus). Symbolen (aq) står för aqua, det latinska ordet för vatten, och betyder att ämnet är löst i vatten. Reaktionsformeln är klar.
Vi tar ytterligare ett exempel. När kolvätet oktan reagerar med syre bildas koldioxid och vatten.
Reaktanternas formler är C8H18 och O2#. #Reaktionsprodukterna är CO2 och H2O.
Lägg varje formelenhet i en tänkt låda. Eftersom syre finns i båda produkterna medan kol bara finns i en av dem, börjar vi med att balansera kolatomerna. En låda C8H18 räcker till #8 # lådor CO2#. # Koefficienten #8 # sätts framför CO2#.#
Nu är det väteatomernas tur; också de finns i endast en av produkterna. De #18 # väteatomerna i C8H18 ger #9 # H2O-molekyler.
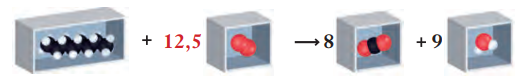
Till sist balanserar vi syreatomerna. Det blir lite krångligare #- # på höger sida har vi #25 # syreatomer. Det behövs alltså #12,5 # lådor syre. Koefficienten #12,5 # placeras framför O2#.#
Kontrollen visar nu att det finns lika många atomer av varje slag till vänster som till höger om pilen #(8 # kolatomer, #18 # väteatomer och #25 # syreatomer). Reaktionsformeln är därmed balanserad, och tvärstrecket över reaktionspilen kan tas bort. Men även om reaktionsformeln nu är balanserad så ska koefficienterna helst vara heltal. Därför multiplicerar vi alla koefficienter i formeln med två.
Till sist kompletterar vi reaktionsformeln med ämnenas aggregationstillstånd. Oktan är flytande vid rumstemperatur medan övriga ämnen är gasformiga.
Exempel
#19. # Naturgas består till stor del av metan. När metan används som bränsle reagerar det med luftens syre. Om förbränningen är fullständig bildas koldioxid och vatten i gasform. Skriv reaktionsformeln.
Lösning
- metan #+# syre #\to# koldioxid #+# vatten
- Ämnenas formler skrivs: CH4 #+# O2 #\not\to# CO2 #+# H2O
- #4# väteatomer räcker till #2# vattenmolekyler
CH4 #+# O2 #\not\to# CO2 #+# #\color{red}{2}# H2O
#4# syreatomer i produkten kräver #2# syrgasmolekyler:
CH4 #+# #\color{red}{2}# O2 #\to# CO2 #+# #2# H2O - Aggregationstillstånden sätts ut:
CH4 #+# #2# O2 #\to# CO2 #+# #2# H2O
Svar
CH4 #+# #2# O2 #\to# CO2 #+# #2# H2O
Exempel
#20.# Propan, C3H8, är en beståndsdel i gasol, ett bränsle som bland annat används på kemilaboratorier, i husvagnskök och till vissa utomhusgrillar. Vid fullständig förbränning av propan bildas koldioxid och vatten. Skriv reaktionsformeln.
Lösning
- Propan#+# syre #\to# koldioxid #+# vatten
- C3H8 #+# O2 #\not\to# CO2 #+# H2O
- C3H8 #+# O2 #\not\to# #\color{red}{3}# CO2 #+# H2O
C3H8 #+# O2 #\not\to# #3# CO2 #+# #4# H2O
C3H8 #+# #\color{red}{5}# O2 #\to# #3# CO2 #+# #4# H2O - C3H8(g)#+# #\color{red}{5}# O2(g) #\to# #3# CO2(g) #+# #4# H2O(g)
Svar
C3H8(g)#+# #5# O2(g) #\to# #3# CO2(g) #+# #4# H2O(g)